Estrutura Primária das Proteínas
Proteínas precisam ser "meio rígidas" (para estabilidade molecular e manutenção de sítios de ligação) e "meio flexíveis" (para serem capazes de dobrar e para se adaptarem às outras moléculas). As características da estrutura primária geram essa mescla.
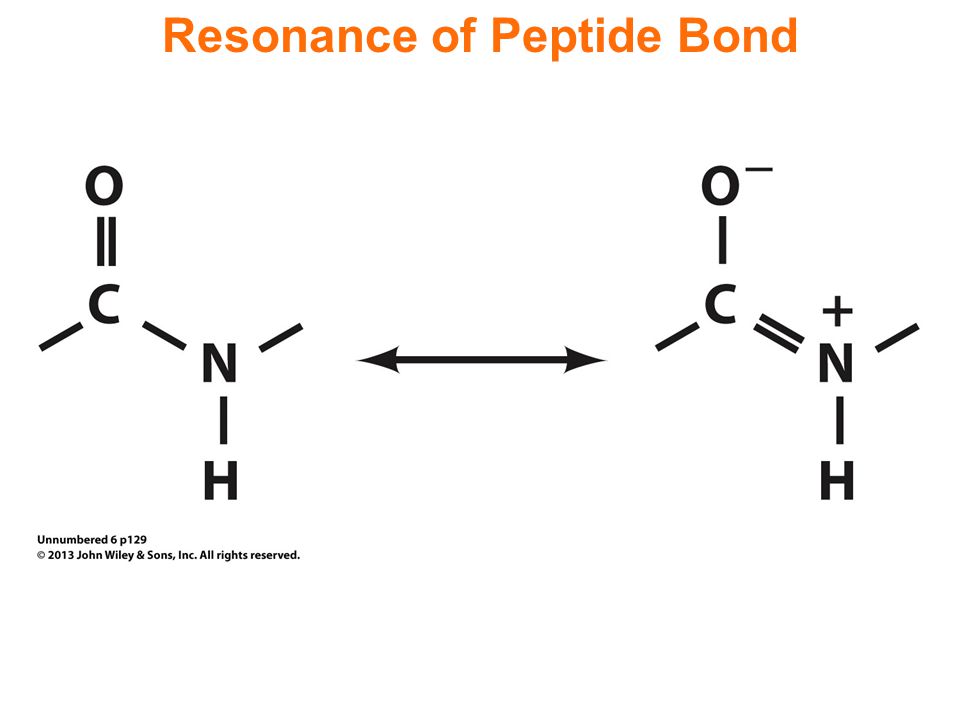
As ligações peptídicas são sempre entre a carboxila de um aminoácido e a amina de outro aminoácido, e é nessa junção que se situa a rigidez da estrutura primária.
A ressonância (alternância do local da dupla ligação) das ligações entre o carbono e o nitrogênio cria planos rígidos nestes locais.
A parte flexível fica por conta do carbono alfa (não envolvido na ligação peptídica) e suas variadas (e geralmente amplas!) cadeias laterais, sempre alternadas (trans) umas com as outras na sequência dos aminoácidos (são os enormes "penduricalhos" das enormes moléculas proteicas!). É a parte que "roda" (ou que "gira", ou se torce) na molécula inteira.
Um exemplo com apenas três aminoácidos diferentes (com cadeias laterais relativamente pequenas):
E agora um exemplo em uma proteína do chamado "antígeno de histocompatibilidade", muito mais complexa:




Comentários