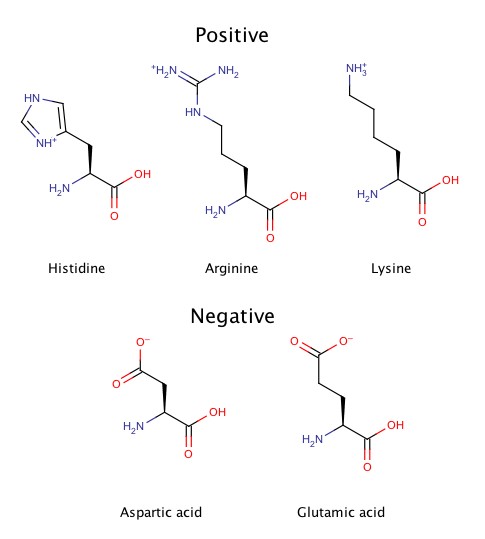
Aminoácidos Carregados
Não sei se você é ligeiro (a) e já entendeu de cara, ou é como eu, e precisa de uma explicaçãozinha a mais sobre a questão das cargas dos aminoácidos.
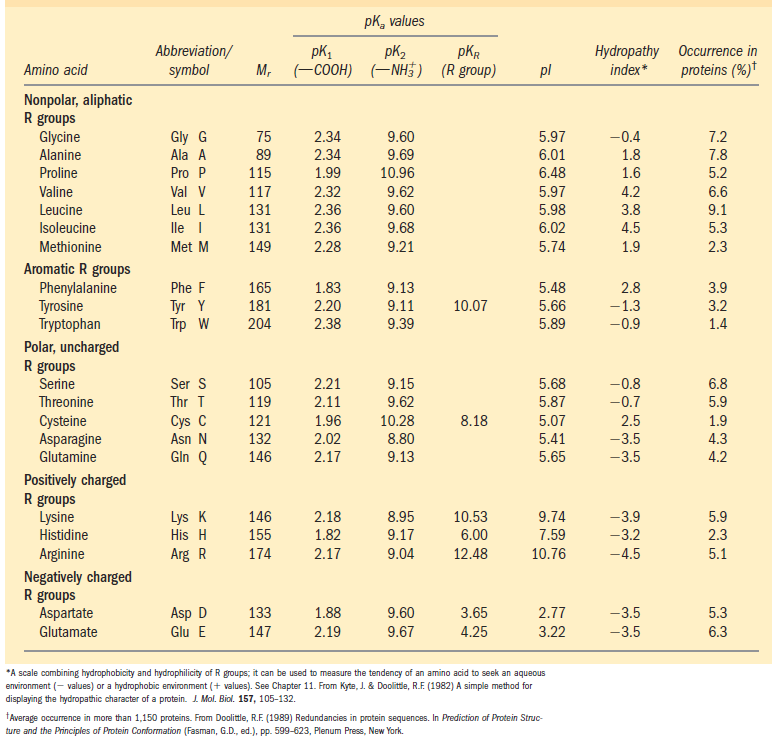
Se precisa, olhe com atenção alguns dados da tabela abaixo:
Primeiramente, é bom esclarecer que se os aminoácidos são classificados como carregados (com carga positiva ou negativa) isso se refere ao pH fisiológico (do corpo humano, ou das células, próximo de 7), e é a partir desse pH que se faz as comparações.
Outro detalhe importante é que as cargas referem-se às cadeias laterais (R), pois todos os aminoácidos têm o hidrogênio das suas carboxilas do carbono alfa liberado em pH bem abaixo de 7 (pK1) e o hidrogênio do grupo amino da cadeia principal liberado em pH bem acima de 7 (pK2).
(os aminoácidos mudam de "sem carga" para carregados negativamente ou de carregados positivamente para sem carga à medida que liberam prótons (H))
Os aminoácidos ditos ácidos (glutâmico e aspártico) perdem o próton da carboxila das suas cadeias laterais em um pH de, respectivamente, 4,25 e 3,65 (bem menor que o fisiológico, em meio ainda ácido). São, portanto, carregados negativamente no pH fisiológico.
As cadeias laterais dos aminoácidos ditos básicos (arginina e lisina) transformam-se de positivamente carregadas à neutras somente no seu pK, que é bem acima de 7 (12,48 e 10,53, respectivamente). Dessa forma, são ainda carregadas positivamente no pH próximo de 7.
A histidina confunde: a cadeia lateral da histidina tem pK de 6 (na tabela) Nesse caso, dissocia no pH próximo ao pH fisiológico. Mas parte das moléculas dissociam em pH mais elevado (até 9,3), por isso (somente) uma parte das cadeias laterais têm carga positiva!


Comentários